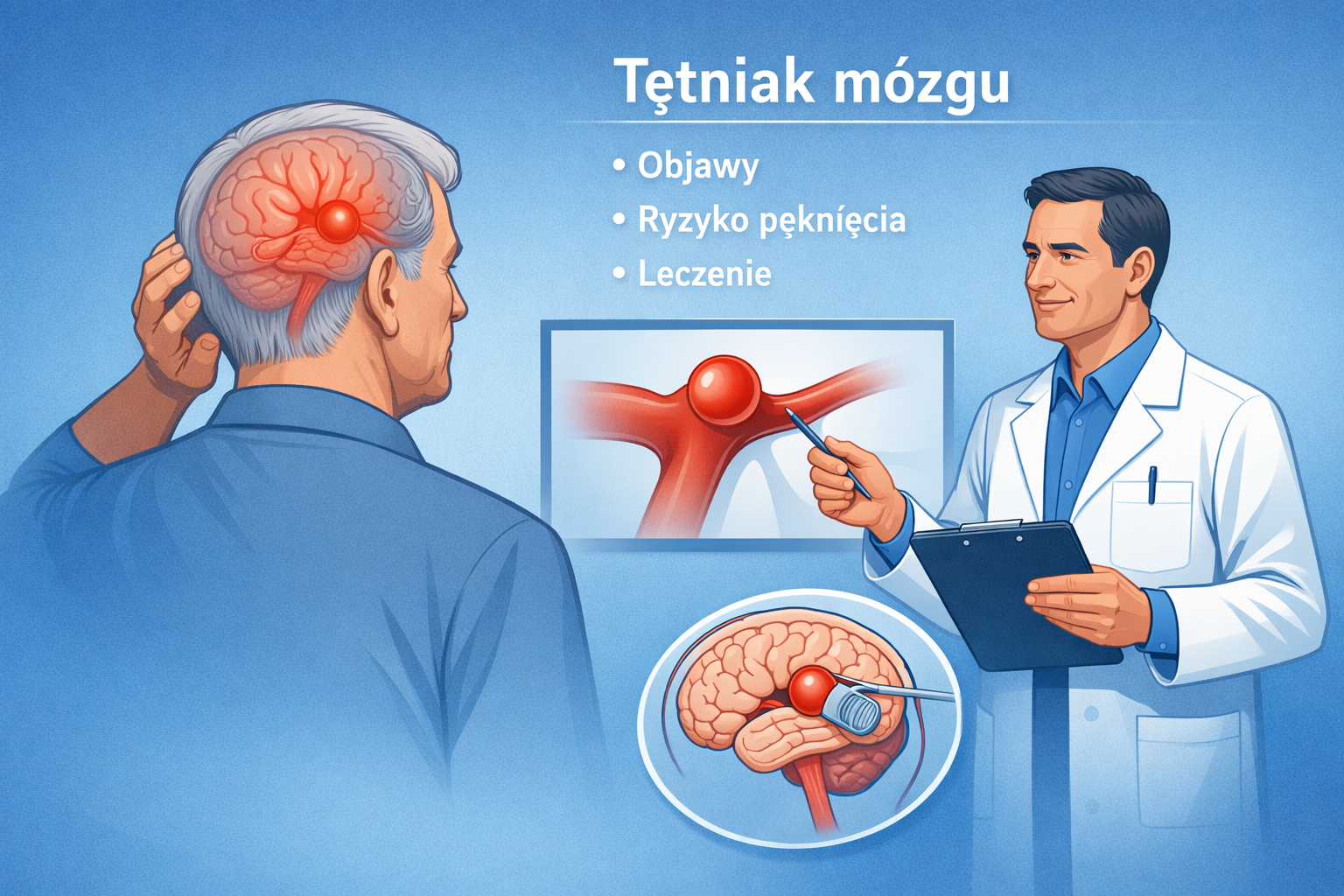
Czym jest tętniak mózgu?
Tętniak wewnątrzczaszkowy to rodzaj nienowotworowego guza wewnątrzczaszkowego, będący miejscowym uwypukleniem ściany tętnicy w obrębie mózgu. Najczęściej ma postać tętniaka workowatego (saccular), który powstaje w miejscach rozgałęzień tętnic, gdzie działają największe siły hemodynamiczne.
Większość tętniaków:
- rośnie powoli,
- nie daje objawów,
- jest wykrywana przypadkowo, np. w badaniach angio-TK (CTA) lub angio-MR (MRA) wykonywanych z innych powodów.
Jak często występują tętniaki mózgu?
Szacuje się, że tętniaki niepęknięte (unruptured intracranial aneurysms, UIA) występują u około 3,2% populacji. Istotne klinicznie jest to, że tylko niewielki odsetek tętniaków ulega pęknięciu w ciągu życia pacjenta.
Rodzaje tętniaków – znaczenie wielkości
Współczesna klasyfikacja kliniczna dzieli tętniaki wewnątrzczaszkowe na:
- małe: <7 mm
- średnie: 7–12 mm
- duże: 13–24 mm
- olbrzymie: ≥25 mm
Znaczenie kliniczne:
- im większy tętniak, tym zwykle wyższe ryzyko pęknięcia,
- większe tętniaki są również bardziej złożone w leczeniu.
Dlaczego powstają tętniaki? Czynniki ryzyka
W większości przypadków nie można wskazać jednej, konkretnej przyczyny. Do najlepiej udokumentowanych czynników ryzyka należą:
- nadciśnienie tętnicze,
- palenie tytoniu,
- wiek oraz płeć (częściej u kobiet),
- dodatni wywiad rodzinny,
- niektóre choroby genetyczne, np. autosomalna dominująca wielotorbielowatość nerek (ADPKD).
Szczególne znaczenie kliniczne mają czynniki modyfikowalne – nadciśnienie i palenie tytoniu. Ich leczenie i eliminacja są zalecane niezależnie od tego, czy tętniak jest obserwowany, czy leczony zabiegowo.
Objawy tętniaka mózgu
Tętniak niepęknięty (UIA)
Większość niepękniętych tętniaków nie powoduje objawów. Symptomy mogą jednak wystąpić, gdy tętniak uciska struktury nerwowe lub mózg:
- ból okolicy oczodołu,
- podwójne widzenie, opadanie powieki (porażenie nerwu III),
- zaburzenia widzenia,
- rzadziej napady padaczkowe lub objawy przypominające udar mózgu.
Uwaga kliniczna: porażenie nerwu czaszkowego (np. opadnięcie powieki, poszerzenie jednej źrenicy) spowodowane przez tętniaka jest traktowane jako istotne wskazanie do pilnej diagnostyki i często leczenia.
Pęknięcie tętniaka – krwotok podpajęczynówkowy (aSAH – aneurysmal subarachnoid hemorrhage)
Typowe objawy obejmują:
- nagły, bardzo silny ból głowy („najgorszy w życiu”),
- nudności i wymioty,
- sztywność karku,
- światłowstręt,
- zaburzenia świadomości lub utratę przytomności,
- objawy ogniskowe (np. niedowład, zaburzenia mowy).
Jest to stan bezpośredniego zagrożenia życia.
Diagnostyka tętniaka mózgu
Podejrzenie pęknięcia tętniaka (tryb pilny)
- TK głowy bez kontrastu – badanie pierwszego wyboru.
- U pacjentów bez deficytów neurologicznych ujemna TK wykonana w ciągu 6 godzin od początku bólu głowy może wykluczać aSAH.
- Przy utrzymującym się podejrzeniu rozważa się punkcję lędźwiową.
- Angio-TK (CTA) lub angiografia cyfrowa (DSA) służą identyfikacji tętniaka i planowaniu leczenia.
DSA pozostaje metodą referencyjną, szczególnie przed leczeniem zabiegowym.
Diagnostyka planowa (tętniak wykryty przypadkowo)
- CTA i/lub MRA są podstawowymi metodami wykrywania i kontroli tętniaków.
- DSA jest stosowana w przypadkach wątpliwych lub przed interwencją.
Czy każdy tętniak wymaga leczenia?
Nie. Kluczowe pytanie brzmi:
Czy ryzyko pęknięcia tętniaka w przyszłości jest większe niż ryzyko leczenia?
W wielu przypadkach właściwym postępowaniem jest obserwacja z kontrolą obrazową, dobieraną indywidualnie.
Ocena ryzyka pęknięcia
Ocena ryzyka pęknięcia tętniaka ma na celu odpowiedź na bardzo praktyczne pytanie: jak duże jest prawdopodobieństwo, że tętniak pęknie w przyszłości i czy to ryzyko jest większe niż ryzyko leczenia. Nie istnieje jeden pojedynczy czynnik decydujący – lekarze analizują kilka elementów jednocześnie.
W codziennej praktyce bierze się pod uwagę przede wszystkim:
- Wielkość tętniaka – im większy tętniak, tym zwykle większe ryzyko pęknięcia. Małe tętniaki (kilka milimetrów) często mają bardzo niskie ryzyko w krótkiej perspektywie, natomiast ryzyko rośnie wraz z rozmiarem.
- Lokalizację – niektóre umiejscowienia tętniaków są statystycznie obarczone większym ryzykiem pęknięcia niż inne.
- Kształt tętniaka – tętniaki o nieregularnym kształcie, z wypustkami lub nierówną ścianą, są traktowane jako potencjalnie mniej stabilne.
- Zmiany w czasie – tętniak, który powiększa się w kontrolnych badaniach obrazowych, wymaga ponownej oceny i często zmiany strategii postępowania.
- Wywiad rodzinny i osobisty – przebyte wcześniej krwotoki podpajęczynówkowe lub występowanie tętniaków w najbliższej rodzinie zwiększają czujność kliniczną.
- Czynniki pacjenta – opisane niżej.
Czynniki pacjenta – co możesz zrobić, aby zmniejszyć ryzyko pęknięcia?
W odróżnieniu od wielkości czy lokalizacji tętniaka, na które pacjent nie ma wpływu, istnieją czynniki zależne od stylu życia i leczenia chorób towarzyszących. Ich kontrola może zmniejszyć obciążenie ściany naczynia i poprawić bezpieczeństwo obserwacji tętniaka.
Najważniejsze czynniki modyfikowalne to:
- Nadciśnienie tętnicze – podwyższone ciśnienie krwi zwiększa siłę działającą na ścianę tętniaka. Skuteczne leczenie nadciśnienia (leki, regularne pomiary, współpraca z lekarzem) jest jednym z najważniejszych elementów zmniejszania ryzyka.
- Palenie tytoniu – palenie uszkadza ściany naczyń i jest jednym z najlepiej udokumentowanych czynników sprzyjających pęknięciu tętniaka. Zaprzestanie palenia realnie poprawia rokowanie, niezależnie od tego, czy tętniak jest leczony, czy obserwowany.
- Kontrola innych chorób przewlekłych – cukrzyca, zaburzenia lipidowe czy choroby nerek powinny być prawidłowo leczone, ponieważ wpływają na ogólny stan naczyń.
- Styl życia – regularna, umiarkowana aktywność fizyczna, utrzymywanie prawidłowej masy ciała, zdrowa dieta i unikanie alkoholu wspierają stabilność układu naczyniowego.
- Przestrzeganie zaleceń kontrolnych – regularne badania obrazowe pozwalają wcześnie wykryć ewentualny wzrost tętniaka i odpowiednio zmodyfikować postępowanie.
Co mogę zrobić już dziś?
- Regularnie kontroluj ciśnienie tętnicze i przyjmuj zalecone leki.
- Jeśli palisz – rozważ całkowite zaprzestanie palenia (to jeden z najważniejszych kroków).
- Dbaj o umiarkowaną, regularną aktywność fizyczną i prawidłową masę ciała.
- Ogranicz alkohol, unikaj nagłych „skoków” wysiłku.
- Zgłaszaj się na zaplanowane badania kontrolne (CTA/MRA).
- W razie nowych objawów nie zwlekaj z kontaktem z lekarzem.
Z punktu widzenia pacjenta istotne jest to, że aktywny udział w leczeniu i kontroli czynników ryzyka ma realne znaczenie. U wielu osób właśnie te działania pozwalają bezpiecznie prowadzić obserwację przez wiele lat.
Warto podkreślić, że samo wykrycie tętniaka nie oznacza automatycznie konieczności leczenia zabiegowego. U wielu pacjentów ryzyko pęknięcia w najbliższych latach jest bardzo niskie i bezpieczniejszym rozwiązaniem jest obserwacja.
Skala PHASES – co to oznacza dla pacjenta?
Jednym z narzędzi pomocniczych jest skala PHASES, która pozwala oszacować ryzyko pęknięcia tętniaka w ciągu 5 lat. Skala ta uwzględnia kilka łatwych do zrozumienia elementów, takich jak:
- kraj/populację,
- obecność nadciśnienia,
- wiek pacjenta,
- wielkość tętniaka,
- przebyte wcześniej krwotoki podpajęczynówkowe,
- lokalizację tętniaka.
Dla pacjenta najważniejsze jest to, że PHASES nie jest wyrocznią, lecz narzędziem wspomagającym decyzję. Ostateczna rekomendacja zawsze opiera się na całościowej ocenie klinicznej, doświadczeniu zespołu oraz rozmowie z pacjentem, uwzględniającej jego obawy, styl życia i preferencje.
Obserwacja tętniaka („watch & wait”)
Kontrole obrazowe
- pierwsza kontrola po 6–12 miesiącach od rozpoznania,
- następnie co 1–2 lata, jeśli obraz pozostaje stabilny.
Do wielokrotnych kontroli często preferuje się TOF‑MRA, które nie wymaga kontrastu ani promieniowania jonizującego.
Kiedy pilnie zgłosić się do lekarza?
- nagły, bardzo silny ból głowy,
- nowe zaburzenia widzenia lub opadanie powieki,
- niedowład, drętwienie, zaburzenia mowy,
- utrata przytomności.
Leczenie tętniaków mózgu
Leczenie tętniaka mózgu nie zawsze jest konieczne i zależy przede wszystkim od tego, czy tętniak pękł, czy jest niepęknięty, oraz jakie jest indywidualne ryzyko pacjenta.
W praktyce klinicznej wyróżnia się dwie zasadnicze sytuacje:
- Tętniak pęknięty, który spowodował krwotok podpajęczynówkowy – w takim przypadku leczenie jest pilne i bezwzględnie konieczne, ponieważ nieleczony tętniak grozi kolejnym, często śmiertelnym krwawieniem.
- Tętniak niepęknięty, który może być obserwowany lub leczony zabiegowo, jeśli spełnia określone kryteria (np. powoduje objawy, rośnie w kontrolach lub wiąże się z wysokim ryzykiem pęknięcia).
Decyzja o leczeniu tętniaka niepękniętego zawsze jest podejmowana indywidualnie, po analizie korzyści i ryzyka oraz rozmowie z pacjentem.
Poniżej opisano główne metody leczenia tętniaków mózgu.
Leczenie endowaskularne (wewnątrznaczyniowe)
Leczenie endowaskularne polega na dotarciu do tętniaka od wewnątrz naczynia krwionośnego, bez konieczności otwierania czaszki. Zabieg wykonuje się przy użyciu cienkich cewników wprowadzanych najczęściej przez tętnicę udową lub promieniową.
Najczęściej stosowane techniki obejmują:
- embolizację spiralami (coiling),
- techniki balon‑ i stent‑asystowane,
- stenty przepływowe (flow‑divertery) w wybranych przypadkach.
Metoda ta jest mniej inwazyjna i często wiąże się z krótszym pobytem w szpitalu, jednak w części przypadków wymaga długoterminowej kontroli obrazowej i czasem ponownego leczenia.
Leczenie operacyjne (klipsowanie)
Klipsowanie polega na mikrochirurgicznym założeniu klipsa na szyję tętniaka, co prowadzi do jego trwałego wyłączenia z krążenia przy zachowaniu drożności prawidłowych tętnic.
Zaletą dobrze wykonanego klipsowania jest zwykle wysoka trwałość efektu leczenia. W tętniakach złożonych mogą być konieczne techniki zaawansowane, takie jak czasowe zamknięcie naczyń lub wykonanie bypassu naczyniowego.
Porównanie leczenia endowaskularnego i operacyjnego – co warto wiedzieć?
Zarówno leczenie endowaskularne, jak i operacyjne są metodami skutecznymi i rutynowo stosowanymi w wyspecjalizowanych ośrodkach. Nie istnieje jedna metoda najlepsza dla wszystkich pacjentów – wybór zależy od typu tętniaka, jego anatomii, wieku i stanu chorego oraz doświadczenia zespołu leczącego.
Leczenie endowaskularne – zalety i ograniczenia
Zalety:
- mniejsza inwazyjność (brak operacji otwartej),
- zwykle krótsza hospitalizacja i szybszy powrót do codziennej aktywności,
- u części pacjentów, zwłaszcza po pęknięciu tętniaka, korzystniejsze wczesne wyniki funkcjonalne.
Ograniczenia i ryzyko:
- większe ryzyko niepełnego zamknięcia tętniaka i jego ponownego wypełniania (rekanalizacji),
- częstsza konieczność kontroli i ponownego leczenia w porównaniu z klipsowaniem,
- możliwe powikłania zakrzepowo‑zatorowe lub udar niedokrwienny.
W obserwacjach długoterminowych konieczność ponownej interwencji po leczeniu endowaskularnym opisywana jest u kilku–kilkunastu procent pacjentów, w zależności od typu tętniaka i zastosowanej techniki.
Leczenie operacyjne (klipsowanie) – zalety i ograniczenia
Zalety:
- bardzo wysoka trwałość zamknięcia tętniaka,
- niższe ryzyko nawrotu i ponownego leczenia w obserwacji wieloletniej,
- szczególnie korzystne u młodszych pacjentów oraz w tętniakach o szerokiej szyi lub złożonej anatomii.
Ograniczenia i ryzyko:
- metoda bardziej inwazyjna, wymagająca operacji otwartej,
- zwykle dłuższy pobyt w szpitalu i okres rekonwalescencji,
- ryzyko powikłań neurochirurgicznych, takich jak krwiak pooperacyjny czy przemijające deficyty neurologiczne.
Leczenie po pęknięciu tętniaka (aSAH)
Po pęknięciu tętniaka najgroźniejsze jest ponowne krwawienie, którego ryzyko jest największe w pierwszych godzinach. Dlatego dąży się do zabezpieczenia tętniaka jak najszybciej, najlepiej w ciągu 24 godzin od początku objawów.
Najczęstsze powikłania i leczenie wspomagające
- wodogłowie ostre – często leczone przez drenaż komorowy zewnętrzny (EVD),
- skurcz naczyń i opóźnione niedokrwienie mózgu – standardem jest wczesne podanie nimodypiny.
Kontrola po leczeniu
- Po leczeniu endowaskularnym: kontrolne badania obrazowe zwykle po 6–12 miesiącach, a dalszy schemat zależy od wyniku.
- Po klipsowaniu: kontrola obrazowa rozważana indywidualnie, szczególnie u młodszych pacjentów.
Rokowanie
Rokowanie przy tętniaku niepękniętym
U większości pacjentów z niepękniętym tętniakiem mózgu rokowanie jest bardzo dobre, zwłaszcza gdy zmiana jest mała, stabilna w kontrolnych badaniach obrazowych i towarzyszy jej dobra kontrola czynników ryzyka (nadciśnienie, palenie tytoniu).
W przypadku decyzji o leczeniu zabiegowym tętniaka niepękniętego zawsze rozważa się bilans korzyści i ryzyka:
- ryzyko poważnych powikłań leczenia (udar, trwały deficyt neurologiczny lub zgon) w wyspecjalizowanych ośrodkach jest zazwyczaj niskie i szacowane na kilka procent,
- u większości pacjentów leczenie przebiega bez trwałych następstw neurologicznych,
- celem leczenia jest zmniejszenie długoterminowego ryzyka pęknięcia przy akceptowalnym ryzyku samego zabiegu.
Dlatego u części chorych bezpieczniejszą strategią pozostaje obserwacja, natomiast u innych – leczenie profilaktyczne.
Rokowanie po pęknięciu tętniaka (aSAH)
Pęknięcie tętniaka mózgu prowadzące do krwotoku podpajęczynówkowego jest jednym z najcięższych stanów w neurologii i neurochirurgii i wiąże się z wysoką śmiertelnością oraz ryzykiem trwałej niepełnosprawności.
Aktualne dane wskazują, że:
- około 1/3 pacjentów umiera w wyniku krwotoku podpajęczynówkowego spowodowanego pęknięciem tętniaka,
- około 10–15% chorych umiera jeszcze przed dotarciem do szpitala,
- całkowita śmiertelność w ciągu 30 dni od krwotoku wynosi około 30–60%, w zależności od ciężkości krwotoku, wieku pacjenta i dostępności szybkiego leczenia.
Wśród pacjentów, którzy przeżyją ostrą fazę choroby:
- około 30–50% pozostaje z trwałymi deficytami neurologicznymi lub poznawczymi, takimi jak niedowład, zaburzenia mowy, pamięci lub koncentracji,
- pozostali pacjenci, szczególnie przy szybkim zabezpieczeniu tętniaka i braku ciężkich powikłań, mogą odzyskać względną samodzielność funkcjonalną.
Na ostateczne rokowanie po pęknięciu tętniaka największy wpływ mają:
- stan neurologiczny pacjenta w chwili przyjęcia do szpitala,
- czas do zabezpieczenia tętniaka,
- wystąpienie powikłań, takich jak ponowne krwawienie, wodogłowie ostre czy opóźnione niedokrwienie mózgu.
Mimo postępu medycyny krwotok podpajęczynówkowy pozostaje chorobą o wysokiej śmiertelności i ryzyku niepełnosprawności, co podkreśla znaczenie wczesnej diagnostyki, kontroli czynników ryzyka oraz – w wybranych przypadkach – profilaktycznego leczenia tętniaków niepękniętych.
Najczęstsze pytania (FAQ)
Czy po leczeniu tętniaka konieczne są kontrole?
Tak. Zakres i częstość kontroli zależą od zastosowanej metody leczenia (leczenie endowaskularne lub operacyjne) oraz od obrazu w badaniach kontrolnych.
Czy po leczeniu można wrócić do normalnego życia?
W wielu przypadkach tak. U większości pacjentów po skutecznym leczeniu i braku powikłań możliwy jest powrót do samodzielnego funkcjonowania i codziennych aktywności, choć tempo rekonwalescencji bywa indywidualne.
Czy tętniak może się pojawić ponownie po leczeniu?
Po klipsowaniu ryzyko nawrotu jest zwykle bardzo niskie. Po leczeniu endowaskularnym konieczne są kontrole obrazowe, ponieważ w części przypadków może dojść do ponownego wypełniania tętniaka.
Czy po leczeniu tętniaka trzeba zmienić styl życia?
Tak. Kontrola ciśnienia tętniczego, zaprzestanie palenia tytoniu oraz zdrowy tryb życia zmniejszają ryzyko dalszych problemów naczyniowych i poprawiają długoterminowe rokowanie.
Kiedy po leczeniu należy pilnie skontaktować się z lekarzem?
W przypadku nagłego, silnego bólu głowy, nowych objawów neurologicznych, utraty przytomności lub szybko narastających dolegliwości należy niezwłocznie zgłosić się do lekarza lub na SOR.
Bibliografia
- Hoh BL, Ko NU, Amin-Hanjani S, Chou SH-Y, Cruz-Flores S, Dangayach NS, et al. 2023 Guideline for the Management of Patients With Aneurysmal Subarachnoid Hemorrhage: A Guideline From the American Heart Association/American Stroke Association. Stroke. 2023;54:e314–e370.
- Thompson BG, Brown RD Jr, Amin-Hanjani S, et al. Guidelines for the Management of Patients With Unruptured Intracranial Aneurysms. Stroke. 2015;46:2368–2400.
- Etminan N, Rinkel GJE. Unruptured intracranial aneurysms: development, rupture and preventive management. Nat Rev Neurol. 2016;12:699–713.
- Greving JP, Wermer MJH, Brown RD Jr, et al. Development of the PHASES score for prediction of risk of rupture of intracranial aneurysms. BMJ. 2014;348:g365.
- Molyneux AJ, Kerr RSC, Yu LM, Clarke M, Sneade M, Yarnold JA, Sandercock P; International Subarachnoid Aneurysm Trial (ISAT) Collaborative Group. International Subarachnoid Aneurysm Trial (ISAT) of neurosurgical clipping versus endovascular coiling in 2143 patients with ruptured intracranial aneurysms: a randomised trial. Lancet. 2005;366(809–817). doi:10.1016/S0140-6736(05)67214-5.
- Lawton MT, Vates GE. Subarachnoid Hemorrhage. N Engl J Med. 2017;377:257–266.
- Etminan N, Chang H‑S, Hackenberg K, de Rooij NK, Vergouwen MDI, Rinkel GJE, Algra A. Worldwide incidence of aneurysmal subarachnoid hemorrhage according to region, time period, blood pressure, and smoking prevalence in the population: a systematic review and meta‑analysis. JAMA Neurology. 2019;76(5):588–597.
- European Stroke Organisation (ESO) Guidelines on management of unruptured intracranial aneurysms. Eur Stroke J. 2022;7:I–XXX.